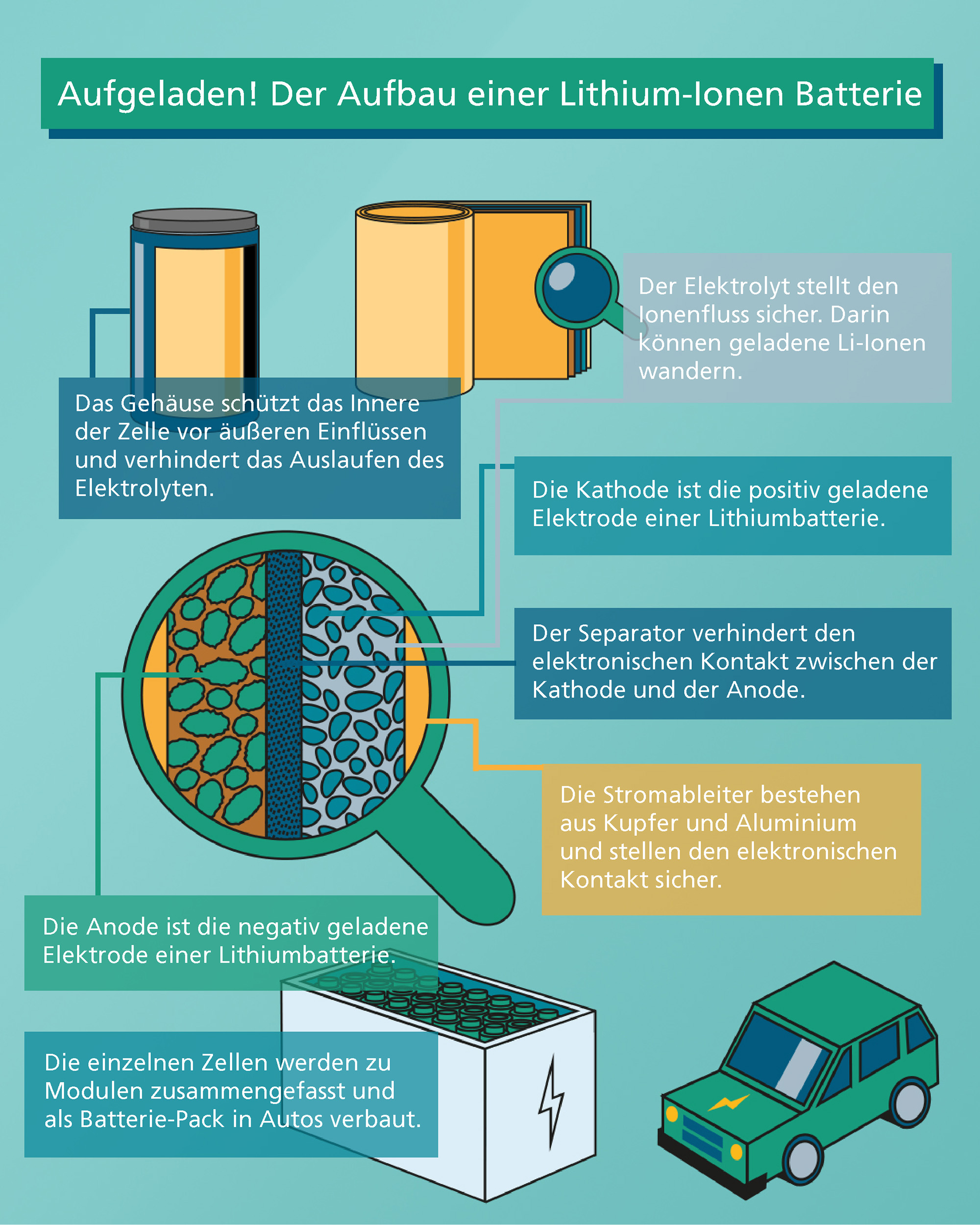
Wie funktioniert eine Batterie?
Durch sie ist unsere Welt wiederaufladbar. Dabei sind sie leicht, können viel Energie speichern und halten lange. Vor etwa 30 Jahren legten Pioniere den Grundstein für das, was heute in nahezu allen Bereichen unseres täglichen Lebens unverzichtbar ist: die Lithium-Ionen Batterie. Doch wie genau ist eine Batterie aufgebaut und wie funktioniert sie? Dies erklären wir in unserem zweiten Blogbeitrag im Rahmen der Informationskampagne »SkillandScaleUp«.
Ganz am Anfang stand die Erkenntnis, dass Lithium gern Elektroden abgibt. Das weiche, an frischer Schnittfläche glänzende Material ist das leichteste Metall auf der Erde und sehr reaktionsfreudig. Über die größten Lithiumreserven weltweit verfügen Chile und Australien. Im Jahr 2020 stellten sie nach Angaben der DERA (2023) knapp 75 Prozent der globalen Bergwerksförderung. Dabei wurde Lithium lange Zeit kaum Beachtung geschenkt. Erst die sich in aufeinander fußende Forschung von John Goodenough, Stanley Whittingham und Akira Yoshino verschaffte Lithium die Aufmerksamkeit, die das Metall bis heute hat.